Ứng dụng tia UV để sát trùng trong chăn nuôi
1. Thông tin cơ bản về tia UV
1.1. Nguyên lý khử trùng bằng tia cực tím
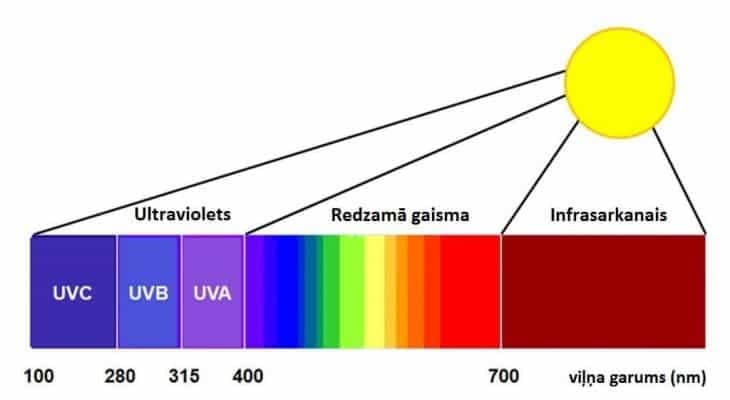
Tia UV hay còn gọi là tia cực tím, là một loại bức xạ điện từ có sóng ngắn hơn tia sáng mà mắt người cảm nhận được , có chiều dài xấp xỉ 400 nanomet, ánh sáng càng tím thì sóng càng ngắn. Tia cực tím có trong tia nắng mặt trời, và tùy thuộc vào cách sử dụng, nó có thể mang lại lợi ích hoặc hậu quả cho con người. Khử trùng bằng tia cực tím là một phương pháp ngày càng phổ biến để tiêu diệt hoặc vô hiệu hóa tất cả các vi sinh vật trong nhiều môi trường như nước, không khí và trên các bề mặt.
Khử trùng bằng tia cực tím là một quá trình không sử dụng hóa chất, không để lại dư lượng độc hại, không giống như các phương pháp khử trùng không khí, bề mặt và nước truyền thống bằng hóa chất. UV đã được chứng minh là có hiệu quả chống lại một loạt các vi sinh vật. Ở bước sóng nhất định, UV gây đột biến vi khuẩn, virus và các vi sinh vật khác. Đặc biệt ở các bước sóng khoảng 260 nm 270 nm, UV phá vỡ liên kết trong phân tử DNA vi sinh vật, tạo ra dimer thymine có thể giết chết hoặc vô hiệu hóa các sinh vật. Đèn thủy ngân phát ra tia cực tím bước sóng 253,7 nm, đèn Diot cực tím (Ultraviolet Light Emitting Diodes, UV-C LED) phát ra tia cực tím có bước sóng từ 255 đến 280 nm. Virus chứa RNA hoặc DNA và do đó dễ bị tiêu diệt khi chiếu xạ. Cả vi khuẩn và nấm đều chứa DNA và đều dễ bị tổn thương trước tia UV. Các bào tử cũng dễ bị tia cực tím tiêu diệt, tia cực tím xuyên qua các mầm bệnh và tấn công DNA của chúng, loại bỏ khả năng sinh sản của chúng.
Dưới tác dụng của tia tử ngoại, phân tử protein bị tổn thương khá mạnh mà biểu hiện thường thấy là dung dịch protein bị vẩn đục, có độ nhớt, tốc độ lắng và mật độ quang bị thay đổi. Ngoài ra tia tử ngoại có thể phá hủy các liên kết hydro trong phân tử protein làm cấu trúc phân tử thay đổi.
Protein thường có vùng phổ hấp thụ 200nm ÷ 400 nm trong đó các acid amin thơm như Tryptophan, Tyrosin, Phenyl-alanine và Cystein đóng vai trò là tâm hấp thụ.
Khi acid amin thơm hấp thụ bức xạ tử ngoại thì trước hết bản thân nó bị phá hủy và sau đó dẫn tới khử hoạt tính enzim
Tia tử ngoại tác động liên kết bất thường giữa 2 NST đơn kế cận. Kết quả là DNA có một chỗ phình trong cấu trúc, gây đột biến NST ở vi sinh vật khiến nó không còn có thể thực hiện những chức năng bình thường nữa.
Liều lượng cần thiết để vô hiệu hóa các vi sinh vật là khác nhau. Vi khuẩn thường dễ bị vô hiệu hóa hơn vi-rút. Với nấm và bào tử thì khó bị vô hiệu hóa hơn, cần có cường độ và thời gian chiếu xạ lớn hơn.
1.2. Tia cực tím hoạt động như thế nào?
Tia cực tím tồn tại trong quang phổ ánh sáng từ 10 đến 400 nm. Phạm vi diệt khuẩn của tia cực tím nằm trong bước sóng 100-280nm, được gọi là UV-C, với bước sóng cực đại cho hoạt động diệt khuẩn là 265nm.
- Phạm vi ánh sáng tia cực tím này được hấp thụ bởi DNA và RNA của vi sinh vật, gây ra những thay đổi trong cấu trúc DNA và RNA, khiến vi sinh vật không có khả năng sao chép. Một tế bào không thể sinh sản được coi là đã chết; vì nó không thể nhân lên đủ số lượng để lây nhiễm trong vật chủ.
- Các hệ thống UV sử dụng đèn diệt khuẩn hồ quang thủy ngân, áp suất thấp được thiết kế để tạo ra lượng bức xạ UV cao nhất – trong đó 90% năng lượng thường được tạo ra ở 254nm. Bức xạ này rất gần với đỉnh của đường cong hiệu quả diệt khuẩn 265nm, bước sóng gây chết nhiều nhất đối với vi sinh vật
| ⭐ Loại tia UV | Bước sóng | Năng lượng/photon |
| ⭐ Tia UV A | Sóng cực tím dài nhất, từ 400 đến 315 nanomet | 3,10-3,94 eV |
| ⭐ Tia UV B | Có tính chất trung bình, chiều dài của nó dao động từ 315 đến 280 nanomet | 3,94-4,43 eV |
| ⭐ Tia UV C | Loại sóng ngắn, với khoảng từ 280 đến 100 nanomet | 4,43-12,40 eV |
| ⭐ NUV | Chiều dài của nó có thể nằm trong khoảng từ 400 đến 300 nanomet | 3,10 -4,13 eV |
| ⭐ MUV | Có độ dài từ 300 đến 200 nanomet | 4,13-6,20 eV |
| ⭐ FUV | Nó có chiều dài từ 200 đến 122 nanomet, | 6,20-10,16 eV. |
| ⭐ Lyman-alpha | Sóng dao động trong khoảng từ 122 đến 121 nanomet | 10,16-10,25 eV |
| ⭐ VUV | nó là một trong những sóng nhỏ nhất, 200 đến 10 nanomet | 6,20-124 eV |
| ⭐ EUV | Nó là tia cực tím ngắn nhất, có chiều dài từ 121 đến 10 nanomet | 10,25-124 eV |
1.3. Ưu điểm
UV-C cung cấp khả năng khử trùng không để lại cặn, vì vậy không cần lo lắng về các chất tồn dư nguy hiểm cần được lau sạch hoặc vô hiệu hóa sau khi quá trình khử trùng diễn ra. Quá trình này thân thiện với môi trường ở chỗ không có hóa chất nguy hiểm hoặc độc hại cần được bảo quản hoặc xử lý chuyên biệt. Vì không có hóa chất nào được thêm vào không khí/nước nên không có sản phẩm phụ nào của quá trình được quan tâm.
Các bóng đèn UV cũng không yêu cầu xử lý hoặc thải bỏ đặc biệt, làm cho hệ thống này trở thành một giải pháp thay thế xanh cho các chất khử trùng hóa học.
Thời gian khử trùng nhanh chóng, với một chu kỳ khử trùng thông thường kéo dài khoảng 15-20 phút. Điều này cho phép thời gian quay vòng cực nhanh đối với các phòng hoặc không gian khác được khử trùng.
Do tính đơn giản của nó, khử trùng UV-C cực kỳ dễ sử dụng. Tất cả các bề mặt trong một khoảng cách nhất định sẽ quan sát thấy mức độ khử trùng được đảm bảo trong một khoảng thời gian nhất định miễn là ánh sáng không bị chặn chiếu trên bề mặt đó.
Việc lập kế hoạch sử dụng hệ thống khử trùng UV-C trở nên rất dễ dàng khi các thông số và giới hạn được thiết lập và hiểu rõ dễ dàng. Không cần thiết lập mô hình luồng không khí với UV-C như bạn làm với hệ thống phun sương.
1.4. Hạn chế (Nhược điểm)
Mặc dù tia cực tím có hiệu quả trong việc vô hiệu hóa nhiều loại vi sinh vật, nhưng việc sử dụng nó cũng có những hạn chế. Vì nó liên quan đến sóng ánh sáng, UV hoạt động theo kiểu “diệt khuẩn trực tiếp”, chỉ chiếu xạ các bề mặt trong tầm nhìn của nó.
- Các bề mặt có thể bị chặn khỏi ánh sáng nếu có vật thể cản đường, giống như một chiếc ô trên bãi biển giúp bảo vệ khỏi ánh nắng mặt trời. Những khu vực bị chặn khỏi tia UV thường được gọi là khu vực bóng tối.
- Các bề mặt trong các khu vực bóng tối này không được khử trùng đầy đủ vì tia UV không có khả năng phản xạ tốt khỏi các bề mặt.
- Các khu vực bóng tối thường được xử lý bằng cách di chuyển nguồn sáng UV sang vị trí thứ hai để phù hợp với việc khử trùng các bề mặt bị chặn khử trùng bằng tia cực tím lần đầu tiên.
- Khoảng cách cũng đóng một yếu tố ảnh hưởng đến hiệu quả của tia UV.
- Cường độ của ánh sáng UV-C càng giảm khi nó càng cách xa nguồn sáng, tuân theo định luật bình phương nghịch đảo. Điều này có nghĩa là ở khoảng cách gấp đôi, UV-C sẽ có ¼ công suất như ở điểm tham chiếu ban đầu. Mối quan hệ này giới hạn mức độ hiệu quả của một nguồn tia UV duy nhất trước khi nó quá yếu để có thể khử trùng đầy đủ.
- Hầu hết các hệ thống giải quyết vấn đề này bằng cách định lượng đầu ra UV-C của chúng ở một khoảng cách nhất định và sử dụng khoảng cách đó để tính thời gian xử lý.
- Có sẵn các cảm biến có thể đo đầu ra UV-C của hệ thống UV tại bất kỳ vị trí nào, sao cho có thể hiểu được thời gian xử lý thích hợp cho vị trí cụ thể đó.
- Tia UV không thâm nhập tốt vào vật liệu hữu cơ, vì vậy, để có kết quả tốt nhất, nên sử dụng UV-C sau khi vệ sinh phòng theo tiêu chuẩn để loại bỏ mọi vật liệu hữu cơ khỏi bề mặt .
1.5. Tính an toàn
Vì UV-C cung cấp bức xạ nên sẽ không an toàn khi ở trong phòng khi quá trình khử trùng bằng UV-C đang diễn ra. UV-C được phân loại là “chất có khả năng gây ung thư ở người” bởi Chương trình Chất độc học Quốc gia. Nó gây nguy hiểm cho da và mắt, vì vậy luôn luôn phải tránh tiếp xúc trực tiếp với UV-C.
UV-C bị chặn bởi một số vật liệu, bao gồm thủy tinh (ngoại trừ thạch anh) và hầu hết các loại nhựa trong, vì vậy có thể quan sát hệ thống UV-C một cách an toàn nếu bạn đang nhìn qua cửa sổ.
1.6. Liều lượng UV
Mức độ bất hoạt của bức xạ tia cực tím có liên quan trực tiếp đến liều tia cực tím được áp dụng. Liều tia cực tím là tích số của cường độ tia cực tím (I) (được biểu thị bằng năng lượng trên một đơn vị diện tích bề mặt) và thời gian tiếp xúc (T).
Do đó: Liều tia cực tím = I x T
Liều này, đôi khi được gọi là lưu lượng, thường được biểu thị bằng milijoule trên centimet vuông (mJ/cm2). Đơn vị “J/m2” được sử dụng ở hầu hết các nơi trên thế giới ngoại trừ Bắc Mỹ, nơi sử dụng “mJ/cm2“.
Việc giảm số lượng vi sinh vật được phân loại bằng thang logarit. Giảm một log là giảm 90% sinh vật. Giảm hai log là giảm 99% sinh vật, tiếp theo là giảm ba log (99,9%), v.v. Liều lượng phơi nhiễm UV-C cần thiết cho mỗi mức giảm được trình bày trong bảng cùng với tài liệu tham khảo được công bố.
| UV Dose (mJ/cm2) Needed For a Given Log Reduction | |||||||
| Log reduction | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | Reference | |
| Spore | |||||||
| Bacillus anthracis spores – Anthrax spores | 24.32 | 46.2 | Light Sources Inc. 2014 | ||||
| Bacillus magaterium sp. (spores) | 2.73 | 5.2 | Light Sources Inc. 2014 | ||||
| Bacillus subtilis ATCC6633 | 24 | 35 | 47 | 79 | Mamane-Gravetz and Linden 2004 | ||
| Bacillus subtilis WN626 | 0.4 | 0.9 | 1.3 | 2 | Marshall et al., 2003 | ||
| Bacillus subtilis spores | 11.6 | 22.0 | Light Sources Inc. 2014 | ||||
| Bacterium | |||||||
| Aeromonas salmonicida | 1.5 | 2.7 | 3.1 | 5.9 | Liltved and Landfald 1996 | ||
| Aeromonas hydrophila ATCC7966 | 1.1 | 2.6 | 3.9 | 5 | 6.7 | 8.6 | Wilson et al. 1992 |
| Bacillus anthracis – Anthrax | 4.52 | 8.7 | Light Sources Inc. 2014 | ||||
| Bacillus magaterium sp. (veg.) | 1.3 | 2.5 | Light Sources Inc. 2014 | ||||
| Bacillus paratyphusus | 3.2 | 6.1 | Light Sources Inc. 2014 | ||||
| Bacillus subtilis | 5.8 | 11.0 | Light Sources Inc. 2014 | ||||
| Campylobacter jejuni ATCC 43429 | 1.6 | 3.4 | 4 | 4.6 | 5.9 | Wilson et al. 1992 | |
| Citrobacter diversus | 5 | 7 | 9 | 11.5 | 13 | Giese and Darby 2000 | |
| Citrobacter freundii | 5 | 9 | 13 | Giese and Darby 2000 | |||
| Clostridium tetani | 13.0 | 22.0 | Light Sources Inc. 2014 | ||||
| Corynebacterium diphtheriae | 3.37 | 6.51 | Light Sources Inc. 2014 | ||||
| Ebertelia typhosa | 2.14 | 4.1 | Light Sources Inc. 2014V | ||||
| Escherichia coli O157:H7 CCUG 29193 | 3.5 | 4.7 | 5.5 | 7 | Sommer et al. 2000 | ||
| Escherichia coli O157:H7 CCUG 29197 | 2.5 | 3 | 4.6 | 5 | 5.5 | Sommer et al. 2000 | |
| Escherichia coli O157:H7 CCUG 29199 | 0.4 | 0.7 | 1 | 1.1 | 1.3 | 1.4 | Sommer et al. 2000 |
| Escherichia coli O157:H7 ATCC 43894 | 1.5 | 2.8 | 4.1 | 5.6 | 6.8 | Wilson et al. 1992 | |
| Escherichia coli | 3.0 | 6.6 | Light Sources Inc. 2014 | ||||
| Escherichia coli ATCC 11229 | 7 | 8 | 9 | 11 | 12 | Hoyer 1998 | |
| Escherichia coli ATCC 11303 | 4 | 6 | 9 | 10 | 13 | 15 | Wu et al. 2005 |
| Escherichia coli ATCC 25922 | 6 | 6.5 | 7 | 8 | 9 | 10 | Sommer et al. 1998 |
| Escherichia coli K-12 IFO3301 | 2.2 | 4.4 | 6.7 | 8.9 | 11.0 | Oguma et al. 2004 | |
| Escherichia coli O157:H7 | <2 | <2 | 2.5 | 4 | 8 | 17 | Yaun et al. 2003 |
| Halobacterium elongate ATCC33173 | 0.4 | 0.7 | 1 | Martin et al. 2000 | |||
| Halobacterium salinarum ATCC43214 | 12 | 15 | 17.5 | 20 | Martin et al. 2000 | ||
| Klebsiella pneumoniae | 12 | 15 | 17.5 | 20 | Giese and Darby 2000 | ||
| Klebsiella terrigena ATCC33257 | 4.6 | 6.7 | 8.9 | 11 | Wilson et al. 1992 | ||
| Legionella pneumophila ATCC33152 | 1.9 | 3.8 | 5.8 | 7.7 | 9.6 | Oguma et al. 2004 | |
| Legionella pneumophila ATCC 43660 | 3.1 | 5 | 6.9 | 9.4 | Wilson et al. 1992 | ||
| Legionella pneumophila ATCC33152 | 1.6 | 3.2 | 4.8 | 6.4 | 8.0 | Oguma et al. 2004 | |
| Leptospiracanicola – Infectious Jaundice | 3.15 | 6.0 | Light Sources Inc. 2014 | ||||
| Microccocus candidus | 6.05 | 12.3 | Light Sources Inc. 2014 | ||||
| Microccocus sphaeroides | 1.0 | 15.4 | Light Sources Inc. 2014 | ||||
| Mycobacterium tuberculosis | 6.2 | 10.0 | Light Sources Inc. 2014 | ||||
| Neisseria catarrhalis | 4.4 | 8.5 | Light Sources Inc. 2014 | ||||
| Phytomonas tumefaciens | 4.4 | 8.0 | Light Sources Inc. 2014 | ||||
| Proteus vulgaris | 3.0 | 6.6 | Light Sources Inc. 2014 | ||||
| Pseudomonas stutzeri | 100 | 150 | 195 | 230 | Joux et al. 1999 | ||
| Pseudomonas aeruginosa | 5.5 | 10.5 | Light Sources Inc. 2014 | ||||
| Pseudomonas fluorescens | 3.5 | 6.6 | Light Sources Inc. 2014 | ||||
| Salmonela paratyphi – Enteric fever | 3.2 | 6.1 | Light Sources Inc. 2014 | ||||
| Salmonella anatum (from human feces) | 7.5 | 12 | 15 | Tosa and Hirata 1998 | |||
| Salmonella derby (from human feces) | 3.5 | 7.5 | Tosa and Hirata 1998 | ||||
| Salmonella enteritidis (from human feces) | 5 | 7 | 9 | 10 | Tosa and Hirata 1998 | ||
| Salmonella infantis (from human feces) | 2 | 4 | 6 | Tosa and Hirata 1998 | |||
| Salmonella spp. | <2 | 2 | 3.5 | 7 | 14 | 29 | Yaun et al. 2003 |
| Salmonella typhi ATCC 19430 | 1.8 | 4.8 | 6.4 | 8.2 | Wilson et al. 1992 | ||
| Salmonella typhi ATCC 6539 | 2.7 | 4.1 | 5.5 | 7.1 | 8.5 | Chang et al. 1985 | |
| Salmonella typhimurium (from human feces) | 2 | 3.5 | 5 | 9 | Tosa and Hirata 1998 | ||
| Salmonella typhimurium | 50 | 100 | 175 | 210 | 250 | Joux et al. 1999 | |
| Salmonella enteritidis | 4.0 | 7.6 | Light Sources Inc. 2014 | ||||
| Salmonella typhimurium | 8.0 | 15.2 | Light Sources Inc. 2014 | ||||
| Salmonella typhosa – Typhoid fever | 2.15 | 4.1 | Light Sources Inc. 2014 | ||||
| Sarcina lutea | 19.7 | 26.4 | Light Sources Inc. 2014 | ||||
| Serratia marcescens | 2.42 | 6.16 | Light Sources Inc. 2014 | ||||
| Shigella dysenteriae ATCC29027 | 0.5 | 1.2 | 2 | 3 | 4 | 5.1 | Wilson et al. 1992 |
| Shigella dyseteriae – Dysentery | 2.2 | 4.2 | Light Sources Inc. 2014 | ||||
| Shigella flexneri – Dysentery | 1.7 | 3.4 | Light Sources Inc. 2014 | ||||
| Shigella paradysenteriae | 1.68 | 3.4 | Light Sources Inc. 2014 | ||||
| Shigella sonnei ATCC9290 | 3.2 | 4.9 | 6.5 | 8.2 | Chang et al. 1985 | ||
| Spirillum rubrum | 4.4 | 6.16 | Light Sources Inc. 2014 | ||||
| Staphylococcus aureus ATCC25923 | 3.9 | 5.4 | 6.5 | 10.4 | Chang et al. 1985 | ||
| Staphylococcus albus | 1.84 | 5.72 | Light Sources Inc. 2014 | ||||
| Staphylococcus aureus | 2.6 | 6.6 | Light Sources Inc. 2014 | ||||
| Staphylococcus hemolyticus | 2.16 | 5.5 | Light Sources Inc. 2014 | ||||
| Staphylococcus lactis | 6.15 | 8.8 | Light Sources Inc. 2014 | ||||
| Streptococcus faecalis (secondary effluent) | 5.5 | 6.5 | 8 | 9 | 12 | Harris et al. 1987 | |
| Streptococcus faecalis ATCC29212 | 6.6 | 8.8 | 9.9 | 11.2 | Chang et al. 1985 | ||
| Streptococcus viridans | 2.0 | 3.8 | Light Sources Inc. 2014 | ||||
| Vibrio anguillarum | 0.5 | 1.2 | 1.5 | 2 | Liltved and Landfald 1996 | ||
| Vibrio cholerae ATCC25872 | 0.8 | 1.4 | 2.2 | 2.9 | 3.6 | 4.3 | Wilson et al. 1992 |
| Vibrio comma – Cholera | 3.375 | 6.5 | Light Sources Inc. 2014 | ||||
| Vibrio natriegens | 37.5 | 75 | 100 | 130 | 150 | Joux et al. 1999 | |
| Yersinia enterocolitica ATCC27729 | 1.7 | 2.8 | 3.7 | 4.6 | Wilson et al. 1992 | ||
| Yersinia ruckeri | 1 | 2 | 3 | 5 | Liltved and Landfald 1996 | ||
| Yeasts | |||||||
| Brewers yeast | 3.3 | 6.6 | Light Sources Inc. 2014 | ||||
| Common yeast cake | 6.0 | 13.2 | Light Sources Inc. 2014 | ||||
| Saccharomyces carevisiae | 6.0 | 13.2 | Light Sources Inc. 2014 | ||||
| Saccharomyces ellipsoideus | 6.0 | 13.2 | Light Sources Inc. 2014 | ||||
| Saccharomyces spores | 8.0 | 17.6 | Light Sources Inc. 2014 | ||||
| Molds | |||||||
| Aspergillius flavus | 60.0 | 99.0 | Light Sources Inc. 2014 | ||||
| Aspergillius glaucus | 44.0 | 88.0 | Light Sources Inc. 2014 | ||||
| Aspergillius niger | 132.0 | 330.0 | Light Sources Inc. 2014 | ||||
| Mucor racemosus A | 17.0 | 35.2 | Light Sources Inc. 2014 | ||||
| Mucor racemosus B | 17.0 | 35.2 | Light Sources Inc. 2014 | ||||
| Oospora lactis | 5.0 | 11.0 | Light Sources Inc. 2014 | ||||
| Penicillium digitatum | 44.0 | 88.0 | Light Sources Inc. 2014 | ||||
| Penicillium expansum | 13.0 | 22.0 | Light Sources Inc. 2014 | ||||
| Penicillium roqueforti | 13.0 | 26.4 | Light Sources Inc. 2014 | ||||
| Rhisopus nigricans | 111.0 | 220.0 | Light Sources Inc. 2014 | ||||
| Protozoan | |||||||
| Chlorella Vulgaris | 13.0 | 22.0 | Light Sources Inc. 2014 | ||||
| Cryptosporidium hominis | 3 | 5.8 | Johnson et al. 2005 | ||||
| Cryptosporidium parvum | 2.4 | <5 | 5.2 | 9.5 | Craik et al. 2001 | ||
| Cryptosporidium parvum, oocysts, tissue culture assay | 1.3 | 2.3 | 3.2 | Shin et al. 2000 | |||
| Encephalitozoon cuniculi, microsporidia | 4 | 9 | 13 | Marshall et al. 2003 | |||
| Encephalitozoon hellem, microsporidia | 8 | 12 | 18 | Marshall et al. 2003 | |||
| Encephalitozoon intestinalis, microsporidia | 3 | 5 | 6 | Marshall et al. 2003 | |||
| G. muris, cysts | <5 | <5 | 5 | Amoah et al. 2005 | |||
| G. muris, cysts, mouse infectivity assay | <2 | <6 | 10 + tailing | Craik et al. 2000 | |||
| Giardia lamblia | <10 | ~10 | <20 | Campbell et al. 2002 | |||
| Giardia muris | <1.9 | <1.9 | ~2 | ~2.3 | Hayes et al. 2003 | ||
| Nematode Eggs | 45.0 | 92.0 | Light Sources Inc. 2014 | ||||
| Paramecium | 11.0 | 20.0 | Light Sources Inc. 2014 | ||||
| UV Dose (mJ/cm2) Needed For a Given Log Reduction | ||||||||
| Log Reduction | ||||||||
| Virus | Host | 1 | 2 | 3 | 4 | 5 | 6 | |
| Adenovirus type 15 | A549 cell line (ATCC CCL-185) | 40 | 80 | 122 | 165 | 210 | Thompson et al. 2003 | |
| Adenovirus type 2 | A549 cell line | 20 | 45 | 80 | 110 | Shin et al. 2005 | ||
| Adenovirus type 2 | Human lung cell line | 35 | 55 | 75 | 100 | Ballester and Malley 2004 | ||
| Adenovirus type 2 | PLC / PRF / 5 cell line | 40 | 78 | 119 | 160 | 195 | 235 | Gerba et al. 2002 |
| Adenovirus type 40 | PLC / PRF / 5 cell line | 55 | 105 | 155 | ston-Enriquez et al. 2003 | |||
| Adenovirus type 41 | PLC / PRF / 5 cell line | 23.6 | ND | ND | 111.8 | Meng and Gerba 1996 | ||
| B40-8 (Phage) | B. Fragilis | 11 | 17 | 23 | 29 | 35 | 41 | Sommer et al. 2001 |
| Bacteriopfage – E. Coli | N/A | 2.6 | 6.6 | Light Sources Inc. 2014 | ||||
| Calicivirus canine | MDCK cell line | 7 | 15 | 22 | 30 | 36 | Husman et al. 2004 | |
| Calicivirus feline | CRFK cell line | 5 | 15 | 23 | 30 | 39 | Ston-Enriquez et al. 2003 | |
| Coxsackievirus B3 | BGM cell line | 8 | 16 | 24.5 | 32.5 | Gerba et al. 2002 | ||
| Coxsackievirus B5 | Buffalo Green Monkey cell line | 6.9 | 13.7 | 20.6 | Battigelli et al. 1993 | |||
| Coxsackievirus B5 | BGM cell line | 9.5 | 18 | 27 | 36 | Gerba et al. 2002 | ||
| Echovirus I | BGM cell line | 8 | 16.5 | 25 | 33 | Gerba et al. 2002 | ||
| Echovirus II | BGM cell line | 7 | 14 | 20.5 | 28 | Gerba et al. 2002 | ||
| Hepatitis A | HAV/HFS/GBM | 5.5 | 9.8 | 15 | 21 | Wiedenmann et al. | ||
| Hepatitis A HM175 | FRhK-4 cell | 5.1 | 13.7 | 22 | 29.6 | Wilson et al. 1992 | ||
| Hepatitis A HM175 | FRhK-4 cell | 4.1 | 8.2 | 12.3 | 16.4 | Battigelli et al. 1993 | ||
| Infectious Hepatitis | N/A | 5.8 | 8.0 | Light Sources Inc. 2014 | ||||
| Influenza | N/A | 3.4 | 6.6 | Light Sources Inc. 2014 | ||||
| MS2 (Phage) | Salmonella typhimurium WG49 | 16.3 | 35 | 57 | 83 | 114 | 152 | Nieuwstad and Havelaar |
| MS2 (Phage) | E. coli ATCC 15597 | 20 | 42 | 70 | 98 | 133 | Lazarova and Savoye 2004 | |
| MS2 (Phage) | E. coli HS(pFamp)R | 45 | 75 | 100 | 125 | 155 | Thompson et al. 2003 | |
| MS2 ATCC 15977-B1 (Phage) |
E. coli ATCC 15977–B1 | 15.9 | 34 | 52 | 71 | 90 | 109 | Wilson et al. 1992 |
| MS2 DSM 5694 (Phage) | E. coli NCIB 9481 | 4 | 16 | 38 | 68 | 110 | Wiedenmann et al. 1993 | |
| MS2 NCIMB 10108 (Phage) |
Salmonella typhimurium WG49 | 12.1 | 30.1 | Tree et al. 1997 | ||||
| PHI X 174 (Phage) | E. coli C3000 | 2.1 | 4.2 | 6.4 | 8.5 | 10.6 | 12.7 | Battigelli et al. 1993 |
| PHI X 174 (Phage) | E. coli WG 5 | 3 | 5 | 7.5 | 10 | 12.5 | 15 | Sommer et al. 2001 |
| Poliovirus – Poliomyelitis | N/A | 3.15 | 6.6 | Light Sources Inc. 2014 | ||||
| Poliovirus 1 | BGM cell line | 5 | 11 | 18 | 27 | Tree et al. 2005 | ||
| Poliovirus 1 | CaCo2 cell-line (ATCC HTB37) | 7 | 17 | 28 | 37 | Thompson et al. 2003 | ||
| Poliovirus Type Mahoney | Monkey kidney cell line Vero | 3 | 7 | 14 | 40 | Sommer et al. 1989 | ||
| Poliovirus Type 1 LSc2ab | MA104 cell | 5.6 | 11 | 16.5 | 21.5 | Chang et al. 1985 | ||
| Poliovirus Type 1 LSc2ab | BGM cell | 5.7 | 11 | 17.6 | 23.3 | 32 | 41 | Wilson et al. 1992 |
| PRD-1 (Phage) | S. typhimurium Lt2 | 9.9 | 17.2 | 23.5 | 30.1 | Meng and Gerba 1996 | ||
| Reovirus Type 1 Lang strain | N/A | 16 | 36 | Harris et al. 1987 | ||||
| Reovirus-3 | Mouse L-60 | 11.2 | 22.4 | Rauth 1965 | ||||
| Rotavirus | MA104 cells | 20 | 80 | 140 | 200 | Caballero et al. 2004 | ||
| Rotavirus SA-11 | MA-104 cell line | 9.1 | 19 | 26 | 36 | 48 | Wilson et al. 1992 | |
2. Cách tính toán thông số UV cần thiết để diệt khuẩn
2.1. Cường độ UV cần thiết để tiêu diệt các mầm bệnh
Các đèn UV đều có công suất phát xạ cụ thể cho từng loại, căn cứ vào lượng phát xạ trên để tính mức phát xạ cho hệ thống UV
Các đèn UV bán trên thị trường có rất ít công ty cung cấp thông số cường độ UV (I). Do đó để xác định cường độ UV thì nên sử dụng thiết bị đo cường độ UV ở khoảng cách 1m tiêu chuẩn. Hoặc tính toán dựa trên thông số cường độ UV lý thuyết, một đèn UVC công suất 30W có cường độ UV xấp sỉ 125µW/cm2 ở khoảng cách 1m tính từ vị trí chiếu đèn.
Tương ứng với công suất của bóng UV để tính tổng công suất phát xạ trong của 1s của bóng, bằng công suất bóng x 125µW/cm2
Quy đổi liều lượng UV từ µW/cm2 sang mJ/cm2 như sau
mJ/cm2= µW/cm2/1000
Ví dụ: một đèn UVC Rạng Đông có công suất tiêu thụ 36W công suất phát xạ UV là 9.5W, khoảng cách từ đèn chiếu đến bề mặt chiếu là 1m thì:
- Công suất phát xạ là 9.5W
- Cường độ UV là 9.5 x 125/30= 39.58 µW/cm2
- Với Rotavirus, để diệt hết 99.9% mầm bệnh thì cần tổng mức UV là 140mJ/cm2, do đó với 1 đèn UV thì thời gian cần chiếu là
T= 3536s = 58.95 minutes
- Để giảm thời gian chiếu UV, có thể tăng số lượng bóng UV lên và thời gian chiếu sẽ giảm tương ứng. Nếu sử dụng 4 bóng thì thời gian chiếu sang chỉ còn cần 14.75 phút
- Trong danh sách các mầm bệnh trong mục lục thì mầm bệnh khó tiêu diệt nhất là Pseudomonas stutzeri với mức năng lượng cần là 195mJ/cm2. Thời gian chiếu sáng cần trong TH sử dụng 4 bóng là 20 phút.
- Cường độ UV được tính cho khoảng cách 1m từ đèn chiếu, khi di chuyển vật cần chiếu cách xa đèn thì cường độ UV bị suy giảm, tuân theo định luật bình phương nghịch đảo. Điều này có nghĩa là ở khoảng cách 2m, UV-C sẽ chỉ còn ¼ công suất như tính toán ở trên. Do đó khi thiết kế phòng chiếu UV cần tính toán kỹ về khoảng cách không gian từ các đèn chiếu đến vị trí được chiếu để đảm bảo hiệu quả sát trùng tốt.
- Công suất đèn sẽ suy giảm theo thời gian, do đó cần kiểm tra để thay thế đèn UV khi công suất đèn giảm còn 70% so với mức ban đầu hoặc giảm xuống dưới 40 µW/cm2. Cần sử dụng thiết bị đo để kiểm tra định kỳ và thay thế kịp thời.
2.2. Các biện pháp hỗ trợ, tăng cường khả năng diệt khuẩn của UV
Do tia UV chỉ có tác dụng diệt khuẩn trên bề mặt được chiếu do đó cần bố trí đèn chiếu để có thể bao phủ tất cả các bề mặt của vật cần sát khuẩn. Mặt dưới của vật cần sát khuẩn là khó chiếu sáng nhất do đó cần sử dụng tấm đỡ bằng lưới để hạn chế diện tích bị chắn. Việc sử dụng đèn chiếu đặt ở nhiều góc độ khác nhau có thể tăng diện tích được chiếu sáng của vật cần sát khuẩn lên cao nhất.
Năng lượng UVC thường không xuyên thấu qua chất rắn và bị giảm đi bởi hầu hết các vật liệu. Thủy tinh, thạch anh, thủy tinh bari-natri và chất dẻo PTFE có độ truyền dẫn qua cao với bức xạ UVC. Năng lượng của UVC có thể bị phản xạ từ ác kim loại đã đánh bóng và một số loại bề mặt sớn và không sơn. Do đó các hộp UV nên sử dụng vật liệu có độ nhẵn, bóng cao để tăng mức phản xạ năng lượng của UV, tăng cường độ bức xạ của không gian trong hộp UV, tăng khả năng diệt khuẩn.
Trong quá trình chiếu UV thì có phản ứng tạo một lượng nhỏ khí Ozone có tác dụng hỗ trợ diệt khuẩn, do đó cần thiết kế hộp UV kín để tăng cường khả năng diệt khuẩn của Ozone.
Để hiệu quả của UV đạt tốt nhất, cần tính toán kỹ số lượng đèn UV cần thiết cho từng không gian khác nhau, đảm bảo công suất phát xạ đủ để diệt tối đa mầm bệnh.
2.3. Các lưu ý khi sử dụng đèn UV để diệt khuẩn
Đèn hơi thủy ngân áp suất thấp phát ra bức xạ diệt khuẩn ở bước sóng 254 nanomet trong khoảng 6000 giờ. Sau thời gian này, đèn không tạo ra đủ bức xạ mặc dù nó có vẻ hoạt động bình thường. Cần kiểm tra đèn diệt khuẩn UV thường xuyên, vì bóng đèn UV có thể tiếp tục cháy mà không phát ra bức xạ hiệu quả. Nên thay đèn UV khi chúng phát ra 70% hoặc ít hơn công suất ban đầu định mức. Đèn UV phải được thay thế khi cường độ bức xạ UV 254 nm trên bề mặt khay làm việc nhỏ hơn 40 microwatt/cm2.
Đèn UV nên được làm sạch thường xuyên. Đèn UV cần được thay thế hàng năm và vệ sinh theo lịch trình để đảm bảo hiệu quả của đèn. Tuổi thọ của bóng đèn UV diệt khuẩn khác nhau tùy theo thiết kế. Ngoài ra, vật liệu làm bóng đèn có thể hấp thụ một số tia diệt khuẩn. Nên tắt đèn và lau bằng miếng mềm thấm cồn. Việc làm sạch là trách nhiệm của nhân viên phụ trách phòng thí nghiệm.
Hiệu quả diệt khuẩn giảm cực độ khi độ ẩm tương đối trên 70%. Do đó cần giữ độ ẩm trong hộp (phòng UV ở mức dưới 70%)
Nhiệt độ và chuyển động của không khí – Làm mát đèn dưới luồng không khí (chẳng hạn như bên trong Tủ an toàn sinh học) cũng có thể làm giảm lượng tia cực tím phát ra, do đó cần cẩn thận để che chắn đèn khỏi luồng không khí trực tiếp qua gương phản xạ parabol.
Do UV chỉ sát khuẩn bề mặt, do đó đồ đưa vào tủ UV cần phải được rải đều trên khay đựng, không sử dụng túi nilon bọc hoặc xếp chồng chất lên nhau. Các vật liệu có thể sát trùng bằng các phương pháp khác (thuốc sát trùng, cồn) thì nên sử dụng các phương pháp đó.
Tác giả: Đặng Đình Trung
Trưởng phòng nghiên cứu đổi mới trang trại – Trung tâm nghiên cứu đổi mới chăn nuôi châu Á – Sunjin Vina

Trưởng phòng dự án và xây dựng chuồng trại chăn nuôi
Có hơn 6 năm kinh nghiệm trong ngành Chăn nuôi Thú Y
